内容
- 1 引言
- 2 表观遗传的分子基础:DNA修饰和组蛋白修饰
-
3 DNA修饰
-
3.1 DNA甲基化
- 3.1.1 DNA甲基化模式的继承
- 3.1.2 机制胞嘧啶甲基
- 3.1.3 DNA甲基化基地翻转的作用
- 3.1.4 5-甲基胞嘧啶诱变和DNA修复
- 3.2 DNA羟甲基化
- 3.3 DNA去甲基化
-
3.1 DNA甲基化
- 4 组蛋白修饰
-
5 表观遗传学癌症
- 5.1 更改表观基因在肿瘤细胞
-
5.2 癌症治疗:治疗后生
- 5.2.1 DNA甲基化抑制剂
- 5.2.2 组蛋白去乙酰化酶抑制剂
介绍
在多细胞生物体,除了配子所有细胞(生殖细胞)具有相同的遗传内容,但也可以执行非常不同的功能。被接通(和表达)的基因-在身体的不同部位的细胞中活性的基因的数目不同。未在一个特定的小区所需要的基因被关闭(静音显影期间)。表观遗传学,不遗传学,不同类型的在生物体的细胞之间辨别。具体表观遗传标记决定特定基因是否被表达。
染色质的修改(蛋白质和基因组DNA的排列紧密配合物)是负责基因表达的外遗传调节。就像基因的变化,当一个细胞分裂表观遗传变化将被保留。一个细胞的表观基因是细胞的整体表观遗传状态。
表观遗传的分子基础:DNA修饰和组蛋白修饰
研究最多的表观遗传修饰的DNA是在胞嘧啶碱基的甲基化。胞嘧啶甲基表示的基因沉默:甲基化基因不转录。
组蛋白修饰也起到表观遗传调控中起重要作用。组蛋白是充当线轴周围的DNA的风在染色质高碱性蛋白。这个压实使得该DNA装配到一个更小的空间会比其他方式。组蛋白具有主要的碱性氨基酸残基(组氨酸,赖氨酸和精氨酸)组成的长N末端尾巴。在组蛋白尾部的基本侧链的翻译后表观遗传修饰发生甲基化,乙酰化,磷酸化和泛素化的形式。
DNA的修饰通常对应于长期后生存储器:一旦甲基化的,基因组DNA仍然通过代甲基。组蛋白修饰,在另一方面,典型地提供短期后生存储器并且可以几个细胞分裂周期之后被逆转。
DNA修饰
DNA甲基化
胞嘧啶到5-甲基胞嘧啶(MC,甲基化图1)是如此重要,以至于5-甲基胞嘧啶已被描述为在基因组中的“第五碱基”。
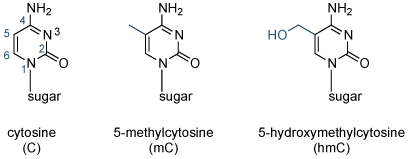
图1 | 表观遗传学上重要的DNA碱基胞嘧啶结构(C),5-甲基胞嘧啶(MC),和5-羟甲基(HMC)。
甲基化发生在CpG位点(或CpG二核苷酸,即,接着为G),但CpG岛(与CpG二核苷酸的高浓度的短stetches DNA)一般不正常组织甲基化。通常,大多数在基因组中(CpG岛以外)的CpG部位的被甲基化。DNA甲基化通过多种机制,包括抑制转录因子结合的阻止转录。
甲基化不影响胞嘧啶的碱基配对:5-甲基胞嘧啶仍形成沃森 - 克里克碱基对与鸟嘌呤。
DNA甲基化模式的继承
在甲基化DNA的结果复制半甲基化的DNA,其中在所述子链是未甲基化的母体链被甲基化。这个半甲基化的DNA的甲基化是必要的,完成甲基化DNA的复制。
DNA甲基化是由DNA甲基转移酶进行的。至少三个独立的DNA甲基(转移酶)参与DNA甲基化。DNA甲基分为两类:从头甲基化(DNMT3A和DNMT3B)甲醇未甲基化的DNA,而保养甲基化(DNMT1)甲醇半甲基化的DNA(图2)。
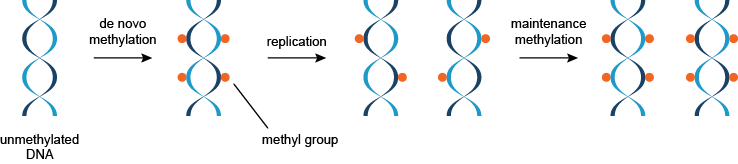
图2 | 这两种类型的DNA甲基化的从头甲基化和DNA的维护甲基的示意图。
半甲基化DNA的甲基化的维护提供了通过几代人的甲基化模式的继承机制,使得DNA甲基化稳定的表观遗传修饰。
胞嘧啶甲基机制
胞嘧啶的甲基化的一般机制涉及通过辅因子电子攻击小号 -adenosyl -1-甲硫氨酸(的AdoMet; SAM),它是甲基转移至C(5)胞嘧啶,并且被转换为小号 -adenosyl -1-高半胱氨酸(的AdoHcy)的过程中。胞嘧啶的C-(5)原子没有特别的亲核,一些帮助从甲基需要将其激活,并增加其亲核性。
胞嘧啶甲基化机制中示出图3中。DNA甲基含有一个保守的胞嘧啶残基上脱质子化的硫醇盐阴离子,充当一个强有力的亲核试剂。半胱氨酸硫醇攻击胞嘧啶的C-(6)原子在一个共轭加成反应,并且在半胱氨酸硫原子和胞嘧啶C(6)原子之间形成的共价键。上胞嘧啶的负电荷通过用谷氨酸残基相互作用稳定。然后亲核攻击呈现的甲基地方小号 -adenosyl -1-蛋氨酸,将其转化为小号 -adenosyl -1-同型半胱氨酸(的AdoHcy)。最后,β-消除横跨C(5)-C(6)键时,释放所述酶。
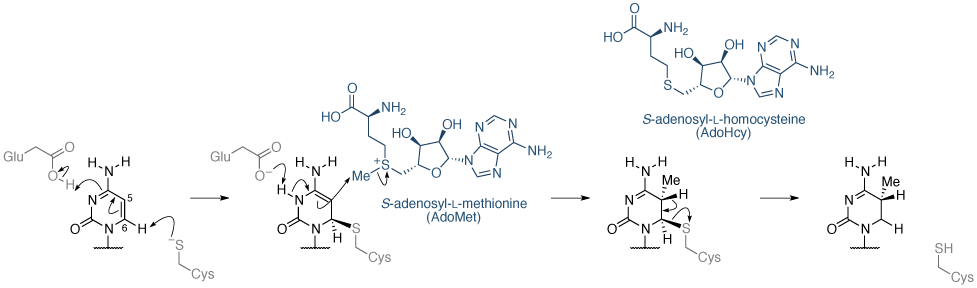
图3 | 胞嘧啶甲基化机制在DNA胞嘧啶残留物,由DNA甲基催化的甲基化机制。
在胞嘧啶的甲基催化的甲基化的机理,需要碱去质子半胱氨酸以形成(更亲核)硫醇盐。所以建议参与这一反应的碱是DNA磷酸基团,通过一个桥连的水分子。因此,DNA的同时充当基材和辅因子(Zangi,2010)。
DNA甲基化基地翻转的作用
每当一个蛋白质靶向DNA双链中的单个的基础上,一个机制必须存在使基访问的酶。用于原核甲基化(和其它DNA修饰酶),晶体结构表明,目标胞嘧啶摆动出完全螺旋的和180°旋转通过结合到酶(图4)。据认为,这个基地翻转机制也被哺乳动物甲基化使用。
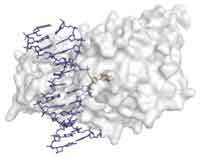
图4 | 在DNA甲基化相应翻转从甲基之间的复合物的晶体结构HHA I和双链DNA(蓝色)显示一台胞嘧啶碱基(橙色)被翻转出双螺旋的,并在酶的活性结合现场。
5-甲基胞嘧啶诱变和DNA修复
当胞嘧啶被突变为尿嘧啶自发脱氨的DNA糖基酶UDG(尿嘧啶DNA糖基化酶)反转的损害,在碱基切除修复机制。当相当于脱氨反应发生在5-甲基胞嘧啶,然而,该产品,胸腺嘧啶,不是由DNA修复酶修复(和5-甲基胞嘧啶是幅度脱氨比胞嘧啶不太敏感的顺序)(图5)。这样导致的CpG二核苷酸成为比将统计学预期(除了在CpG岛,在没有甲基化,因此没有突变为胸腺嘧啶,发生)的基因组中非常罕见。

图5 | 胞嘧啶和5-甲基胞嘧啶脱氨自发脱氨转换胞嘧啶为尿嘧啶,而5-甲基胞嘧啶到胸腺嘧啶。尿嘧啶通过DNA修复酶(UDG,一个DNA糖基化酶)转换回胞嘧啶,但胸腺嘧啶不转换回5-甲基胞嘧啶。
DNA羟甲基化
如果5-甲基胞嘧啶(MC)是“五基地”在genone 5-羟甲基(HMC)是“六基地”。5-甲基胞嘧啶(MC)向5-羟甲基(HMC)的氧化通过TET酶进行时,2-酮戊二酸加氧家族的成员。它它建议这个羟化5-甲基胞嘧啶可能会在第一步的DNA去甲基化活跃的途径。
DNA去甲基化
的胞嘧啶碱基的甲基化最初被认为是不可逆的,并没有直接的DNA脱甲基酶已被鉴定; 但DNA去甲基化是目前已知的是一个重要的过程。
DNA去甲基化是必要的沉默基因的激活,和在胚胎发育过程中“清洁的基因组石板'(这允许胚胎干细胞分化成任何细胞)。
被动DNA去甲基化
很容易设想DNA去甲基化可能如何跨代发生,通过DNA复制过程中的甲基化的信息的损失。缺乏维修甲基下列DNA复制将导致全球去甲基化的DNA。
维护的DNA methyltransferas DNMT1不能识别5-羟甲基,因此对于更具体的被动甲基一个可能途径用5-甲基氧化成5-羟甲基开始。5-羟甲基具有相同碱基配对化学为胞嘧啶和5-甲基胞嘧啶,所以它会被复制到胞嘧啶; 但不会发生随后的甲基/羟甲基化。总的结果是去甲基化。
被动去甲基化的胞嘧啶的这些机制都需要DNA的复制。这种依赖的复制途径是没有用的,如果下一轮DNA复制之前,需要去甲基化。尽管明显缺乏一个哺乳动物DNA脱甲基酶,涉及一个途径活性(复制无关)demethylaton最近被提出。
积极DNA去甲基化
在植物中,活性DNA去甲基化是通过实现碱基切除修复,用的水解开始Ñ 5-甲基胞嘧啶的糖苷键由特定DNA糖基化酶。但是,没有涉及5-甲基胞嘧啶特异性DNA糖基化酶去甲基化途径已在哺乳动物中鉴定。如果5-甲基胞嘧啶首先转换成另一种碱,碱切除修复途径可能是可行的。
以下MC的氧化HMC,进一步氧化成5- formylcytosine(FC),然后5-carboxycytosine(CAC)已观察到,还通过TET酶催化。这些“第七'和在细胞已被检测到的”第八'碱基,可能是重要的后生状态在他们自己的权利。两个替代机制已经被建议用于5- carboxycytosine至胞嘧啶转化:5- carboxycytosine的直接脱羧,由身份不明脱羧酶催化; 或碱基切除修复,通过由胸腺嘧啶DNA糖基化酶(TDG)5- carboxycytosine切除启动。另一途径已经提出,其中酶催化的胞嘧啶脱氨后跟错配修复。
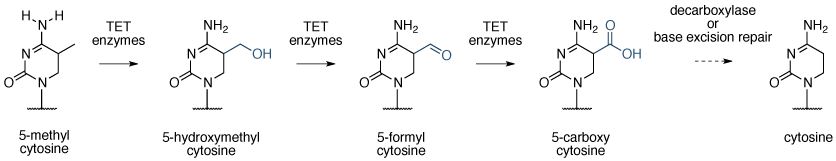
图6 | 活性胞嘧啶脱甲基化方案表示5-甲基胞嘧啶的活性脱甲基化通过iteractive氧化成5-hydroxycytosine,5- formylcytosine和5- carboxycytosine,随后脱羧/碱基切除修复。吴,张,改编纳特。启分子。细胞生物学, 11,607-620,2010。
组蛋白修饰
虽然组蛋白不聚合酶直接交互,对其进行修改可能影响DNA包裹周围的道路,从而影响哪些基因被表达。组蛋白修饰是必需的招募辅因子和用于聚合酶结合,并用于维持染色质的稳定性。组蛋白的大部分修饰发生在他们的非结构化的,碱性的N-末端尾巴。重要的组蛋白修饰包括乙酰化(在赖氨酸残基)和甲基化(在赖氨酸和精氨酸残基)(图7)。

图7 | 重要的表观遗传组蛋白修饰结构
组蛋白乙酰化
组蛋白乙酰化是最广泛研究的后生蛋白质修饰。组蛋白尾巴的具体赖氨酸残基的乙酰化与基因激活相关。赖氨酸乙酰化,由组蛋白乙酰转移酶(帽)催化,中和上赖氨酸残基的正电荷。这种电荷中和被认为是降低组蛋白和DNA之间的亲和力,开放获取DNA的转录因子和聚合酶,并因此增强转录。
在组蛋白乙酰化,一个交谈谷氨酸残基作为一个一般的基础上,激活所述赖氨酸ε氨基上乙酰CoA的羰基的亲核攻击。四面体中间形式,然后用折叠辅酶A(CoASH)的损失,一般乙酰基赖氨酸(图8)。

图8 | 赖氨酸乙酰化机制赖氨酸的乙酰化机制,组蛋白赖氨酸的乙酰基转移酶催化。乙酰辅酶A,乙酰基的来源,被转换为辅酶A(CoASH)的反应。
组蛋白脱乙酰
赖氨酸乙酰化是可逆的:脱乙酰化,由组蛋白脱乙酰(HDS或的HDAC)催化抑制了转录。乙酰赖氨酸的脱乙酰化涉及的水对乙酰羰基的亲核攻击。水活化的机制是不同的脱乙酰酶不同。有四类组蛋白去乙酰化酶(I-IV),即通过不同的机制催化乙酰基赖氨酸的乙酰:类I,II和IV使用主动上门金属依赖机制(图9),而III类的HDAC运行时使用烟酰胺腺嘌呤二核苷酸(NAD +)依赖性催化机制。
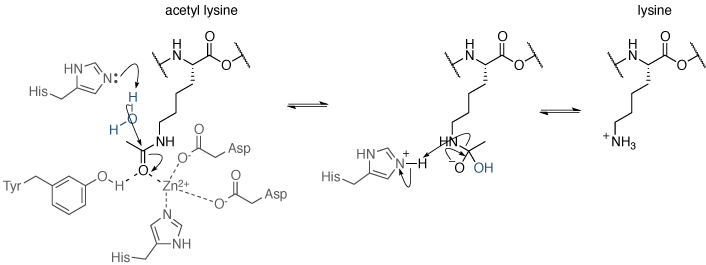
图9 | 赖氨酸乙酰化机制,由I类,II和IV组蛋白脱乙酰乙酰基赖氨酸的脱乙酰机制。
组蛋白甲基化
赖氨酸的甲基化调节作用是复杂的:一些赖氨酸残基的甲基化与转录相关联,而其它赖氨酸甲基化与转录抑制有关。
组蛋白赖氨酸残基在经受甲基化Ñ(ε)原子,由赖氨酸甲基转移(KMTs)催化。组蛋白赖氨酸甲基转移催化单,二和赖氨酸的三甲基化(图10)。

图10 | 赖氨酸单,二和三甲基化表示单-计划- ,二-和赖氨酸三甲基。
的甲基的来源是小号 -adenosyl -1-甲硫氨酸(的AdoMet),将其转化为小号 -adenosyl -1-同型半胱氨酸(的AdoHcy)在反应(图11)。
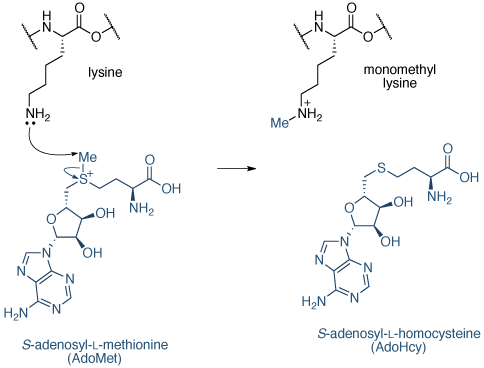
图11 | 赖氨酸甲基化机制赖氨酸甲基化机制由组蛋白甲基化赖氨酸(KMTs)。
组蛋白也可以在精氨酸残基甲基化。与赖氨酸的甲基化,精氨酸甲基化调节作用是复杂的。
组蛋白去甲基化
与乙酰化赖氨酸甲基是可逆的; 和赖氨酸的脱甲基化,通过赖氨酸去甲基(KDMS)催化,是一个重要的后生过程。
赖氨酸去甲基化酶分为两大CLASSE:在LSD1 / KDM(赖氨酸去甲基化酶特定)家族和JHDM(十文字组蛋白去甲基)家族。酶的两种类的机制需要一个氧化反应。由LSD1 / KDM1家族的酶催化的赖氨酸去甲基化的机理在示出图12。
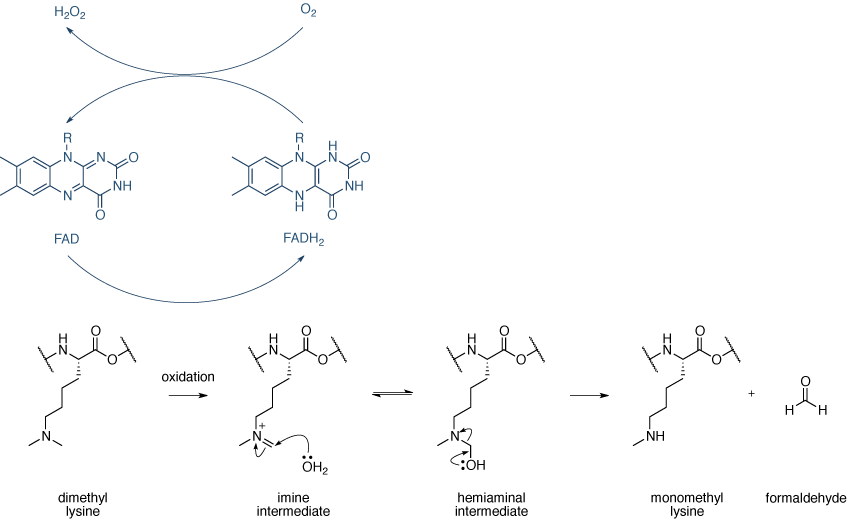
图12 | 赖氨酸甲基化机制赖氨酸去甲基化机制,由LSD1 / KDM1家族的酶来催化。
在癌症表观遗传学
角色表观遗传学的发现起着癌症取得了最近的表观遗传学巨大的利益的领域,并了解它导致了新的癌症治疗方法。
表观遗传修饰是在健康细胞的发育和功能是至关重要的。在表观基因改变(例如,在DNA的甲基化模式),从而导致不正确的激活或sigalling途径的失活,是癌症的标志。癌症是长期被视为一种遗传性疾病,但它已成为明确最近,表观遗传的因素也同样重要。
改变表观基因在肿瘤细胞中
DNA甲基化
在正常细胞中,DNA甲基化发生在CpG位点,而CpG岛保持未甲基化的。在肿瘤细胞中,DNA甲基化在CpG位点的水平普遍较低(低甲基化),而CpG岛可以被甲基化(甲基化)。DNA的甲基化导致的基因的异常活化。
组蛋白修饰
具体组蛋白修饰与肿瘤形成有关,包括组蛋白4赖氨酸16(H4K16),由组蛋白脱乙酰酶(HDACs)介导脱乙酰。据认为,这组蛋白脱乙酰导致的肿瘤抑制基因的抑制。癌细胞也显示在赖氨酸残基的甲基化模式,包括H3K9和H3K27的变化。
癌症治疗:治疗后生
而基因突变是不可逆的,后生修改是,在不同程度上是可逆的。这开辟了逆转癌细胞表观遗传修饰的细胞恢复至其健康状态的可能性。在癌症治疗后生治疗的目标是一种扭曲的表观恢复到“正常的”表观基因。
DNA甲基化抑制剂
细胞毒性核苷类似物5-氮杂胞苷(阿扎胞苷)和5-氮杂-2'-脱氧胞苷(地西他滨)最近被批准用于某些类型的癌症的治疗。氮杂胞苷和地西他滨被纳入快速增长的肿瘤细胞的DNA复制过程中的DNA,并复制后,抑制甲基化。甲基化的丧失导致的肿瘤抑制基因的活化,抑制肿瘤生长。
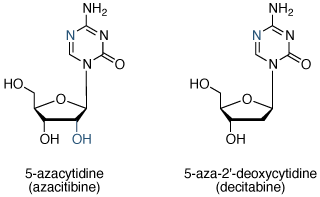
图13 | 阿扎胞苷和地西他滨5-氮杂胞苷(阿扎胞苷)和5-氮杂-2'-脱氧胞苷(地西他滨)的结构,批准用于癌症治疗的DNA甲基化的核苷抑制剂。
可以抑制DNA甲基而不被掺入DNA的非核苷类化合物正在推行,但没有有效的抑制剂还没有被发现。
组蛋白去乙酰化酶抑制剂
的组蛋白乙酰化模式的恢复已被证明具有抗肿瘤活性相关,和组蛋白脱乙酰酶(HDAC)抑制剂已经研究为此。辛二酰苯胺氧肟酸(SAHA,伏立诺他; Zolinza),HDAC的一些类的抑制剂,被批准为2006年治疗皮肤T细胞淋巴瘤。

图14 | 辛二酰苯胺氧肟酸(SAHA,伏立诺他; Zolinza) (萨哈)的辛二酰苯胺氧肟酸结构,一种组蛋白去乙酰化酶(HDAC)抑制剂批准在2006年治疗皮肤T细胞淋巴瘤。
